
实验新知
当我们需要证明蛋白间相互作用时,Co-IP几乎是必做项目。利用细胞样本,证明胞内蛋白的相互作用,阐明现象后的分子机制。
Co-IP实验简而言之,就是一场爱的追捕小游戏,抗体捕获蛋白(抗原),珠子捕获抗体-抗原复合物。
现在,小编带你梳理IP实验的步骤和注意点,让你在这场爱的追逐中立于不败之地。
· 前言
IP:通过对某蛋白质的富集,研究该蛋白的特性(如翻译后修饰等)。
Co-IP: 通过对某蛋白质的富集,研究与其结合的其他蛋白(即蛋白-蛋白相互作用、蛋白复合物等)。
关键试剂选择:使用可以富集蛋白的抗体是Co-IP的前提,因此,适用于IP的抗体都可应用于Co-IP。
· 要点
裂解翻转于低温,避免降解是根本。
抗体珠子需加足,抗体蛋白过夜孵。
蛋白丰度了于心,重链轻链已变性。
Protocol与datasheet,研读操作需仔细。
· 流程
STEP 1:样本制备
考虑因素:做IP还是Co-IP?抗体对抗原表位是否有特殊要求?
· IP:裂解、洗涤时,根据不同下游检测手段,可以考虑使用更剧烈的变性裂解液
· Co-IP:裂解、洗涤时使用非变性裂解液,如 Cell Lysis Buffer(#9803)
【实验过程】
(以Agarose beads进行Co-IP为例)
1. 弃培养基,用预冷的PBS润洗一次。
2. 弃PBS,加入0.5mL 1X Cell Lysis Buffer (添加蛋白酶抑制剂,覆盖10cm dish),冰上孵育5min。
3. 刮下细胞,移入离心管,置于冰上。
4. 冰浴中对样品超声3次,每次5sec。
5. 4°C,14000 X g离心10min。将上清转移到新的离心管中,即为细胞裂解物。(可进行BCA测定#7780,保留一部分作为Input组)
STEP 2:Pre-clearing
考虑因素:实验结果的背景是否比较高?
· Pre-clearing的目的:去除细胞裂解物与珠子非特异性结合造成的背景。
· 预实验可跳过该步骤或进行平行比较,如实验结果背景较高,则建议进行该步。
【实验过程】
(一般每个IP样本需200-500μl细胞裂解物,浓度在1μg/μL左右,以下步骤以200μl细胞裂解物进行IP为例)
1. 200μl细胞裂解物加入20μl Protein A或Protein G珠浆中,4°C旋转混合30-60min。注意:吸取珠子时将枪头剪成粗口,防止损伤珠子。
2. 4°C,离心10min。
3. 取上清,进行后续步骤。
STEP3:结合(蛋白-抗体-珠子)
考虑因素:抗体、珠子选择和使用有哪些注意点?
【实验过程】
1. 在细胞裂解物中加入抗体。如果使用的是CST抗体:根据说明书稀释比加入抗体即可。以1:50为例,细胞裂解物的浓度调整为1μg/μl左右, 则200μL裂解物需加入4μl抗体。其他抗体使用请参考抗体说明书。
注意:设立Isotype Control对照组,即使用等质量的、与IP抗体来源相同、亚型相同的免疫球蛋白进行IP实验。过多的Isotype control可造成高背景。CST抗体浓度见产品页面“说明书和文档”中的“分析证书”,若批次不同,请致电400-647-3287查询。
2. 4°C翻转混合过夜。(让抗体找到抗原)。
3. 加入20μl Protein A或Protein G珠浆,4°C缓慢摇晃混合1-3h。(让珠子找到抗体)注意:吸取珠子时将枪头剪成粗口,防止损伤珠子。
4. 4°C,离心30sec。使用预冷的500μl 1XCell lysis buffer洗珠子5次,弃掉洗涤buffer。
STEP4:洗脱
考虑因素:抗体和珠子是非共价结合,所以抗体-蛋白会一起被洗脱下来。
【实验过程】
1. 用20-40μl 3X SDS sample buffer混悬沉淀(即珠子及连接其上的抗体、蛋白),震荡,离心30sec。
SDS+DTT buffer(最常用)
· a. 洗脱效率高,获得高浓度样品;
· b. 对蛋白进行变性,将IP抗体一同洗脱;
· c. 如后续进行其他检测(如Kinase Assay),则需使用兼容下游检测的Elution buffer。
2. 95-100°C煮样2-5min,14000 X g离心1min。
3. 上样15-30μl,进行Western Blot。
· 其他注意点
上样时至少设立三组
· Input组:即未经IP的细胞裂解物,判断目标蛋白位置和富集相对程度
· Isotype 组:使用Isotye Control IP的产物,作为蛋白与IgG结合的背景信号
· IP组:IP实验组
WB杂交蛋白
· IP同靶标的抗体:判断蛋白有无富集
· 待测蛋白:即实验结果,判断有无蛋白互作
WB检测
使用SDS Sample buffer洗脱时,洗脱的内容物里除了捕获的蛋白,还有变性的IP抗体IgG,即IgG重链(~55kD)和轻链(~25kD),它们可与WB二抗发生反应,对结果解读造成干扰。
· 解决方法1
>> 使用构象特异性二抗,即只检测有空间构象的IgG,不检测变性的IgG;
>> 使用轻链或重链特异性二抗,以排除重链或轻链的干扰。
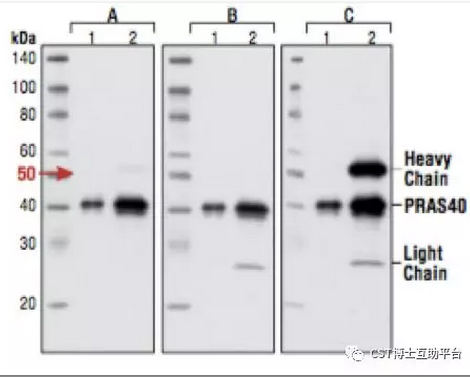
Lane1. 10% input of untreated HeLa cells
Lane2. IP:PRAS40 IB:PRAS40
A:#3678-构象特异;
B:#3677-抗轻链;
C:#7074 Anti-rabbit IgG, HRP-linked Antibody
· 解决方法2
>> 使用与IP抗体不同宿主的Wb一抗,如:IP-小鼠抗A;IB-兔抗A;二抗:抗兔IgG-HRP。
· 解决方法3
>> 使用与抗体共价偶联的珠子。
磁珠法注意事项
· 储存磁珠的液体无法与IP兼容,故使用时需要移除储存液,并清洗。
· 磁珠与抗体的结合条件与琼脂糖珠不同,室温下旋转孵育20min即可。
· 由于磁珠的特性,无需离心移液,使用磁力架(#7017或#14654)即可。
· 磁珠法IP步骤点击此处
· 常见问题
高背景
制备样品中可能有不完全溶解的大的蛋白复合体
- 制备样品后进行短暂超声处理(3次,每次5秒钟),然后离心纯化,取上清后进行后续试验
洗涤不彻底
- 多次洗涤,并逐渐增加洗涤缓冲液中的NaCl和去垢剂浓度
非特异性蛋白吸附于珠子上
- 进行Preclearing以排除非特异性吸附
抗体本身特异性不好
- 选择合适的抗体,可以考虑单抗
使用了太多的抗体
- 进行条件优化减少抗体
使用了过多的细胞或组织进行裂解
- 减少样本量,我们推荐100-500μg细胞裂解物
抗原降解
- 保证样品中加入了蛋白酶/磷酸酶抑制剂,尽量使用新鲜制备的样品
WB步骤
- 使用规范的WB,注意封闭、一二抗稀释的条件
无信号
目的蛋白在样本中表达量低或者不表达
- 首先对目的蛋白表达量进行检测,或者加大IP中加入的蛋白裂解物并进行预处理。
- 胞内蛋白互作的水平较低或没有互作,增加蛋白裂解物或进行诱导处理。
细胞裂解液使用不当
- 根据实验需要选择,慎重考虑。
目的蛋白未被洗脱
- 保证使用合适的洗脱液,保证洗脱液的强度和pH值合适。
抗体没有很好的与珠子相互结合
- 选择合适的珠子。
抗体选择不当或者不工作
- 利用WB对抗体进行验证
抗体使用不足
- 查阅文献或者说明书,并多次优化或选择合适的抗体使用量。
· Co-IP Quick Start
|
IP抗体为兔抗 |
|
|
Cell Lysis Buffer |
|
|
PMSF |
|
|
Beads |
|
|
Isotype Control |
兔多抗:#2729 兔单抗:#3900 |
|
Sample Buffer |
|
|
IP二抗 |
Mouse Anti-rabbit IgG (Conformation Specific) (L27A9) mAb (HRP Conjugate) #5127 |
|
IP抗体为鼠抗 |
|
|
Cell Lysis Buffer |
|
|
PMSF |
|
|
Beads |
|
|
Isotype Control |
IgG1:#5415 IgG2a:#61656 IgG2b:#53484 IgG3:#37988
|
|
Sample Buffer |
|
|
IP二抗 |
Rabbit Anti-Mouse IgG (Light Chain Specific) (D3V2A) mAb (HRP Conjugate) #58802(仅检测轻链,避免~55KD的重链干扰) |
(来自CST博士互助平台)
联系我们:
明睿生物技术有限公司(MRBiotech)
地址:上海市徐汇区医学院路69号华业大厦15楼B座
电话:021-6404 9450 传真:021-6418 6535
网址:www.mrbiotech.com.cn 邮编:200032